| Практическая работа №8 Тема: Расчет трубчатой печи для конверсии природного газа в производстве водорода. | |
| Автор: drug | Категория: Прочее | Просмотров: | Комментирии: 0 | 11-08-2013 15:09 |
Практическая работа №8
Тема: Расчет трубчатой печи для конверсии природного газа в производстве водорода.
Цель: Научиться составлять материальный и тепловой балансы трубчатой печи для конверсии природного газа в производстве водорода.
Теоретические основы
Наиболее перспективным методом получения водорода является конверсия метана. Конверсия метана до водорода осуществляется в две стадии. Первая стадия – конверсия метана на никелевом катализаторе при 850-9000С:
СН4 + Н2О ® СО + 3Н2
Вторая стадия – конверсия оксида углерода при 410-5000С на железохромовом катализаторе:
СО + Н2О ® СО2 + Н2
На промышленных установках первая стадия конверсии осуществляется в трубчатых печах.
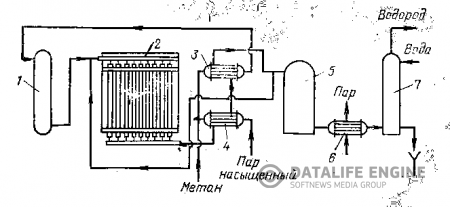
Рисунок 8.1 Технологическая схема получения водорода
1- адсорбер; 2 – печь; 3 – теплообменник; 4 – пароподогреватель; 5 – конвертор; 6- котел утилизатор; 7- конденсационная башня.
Природный газ нагревается в теплообменнике 3 до 3000С за счет тепла конвертированного газа и поступает в абсорбер 1, заполненный железо-содовой массой и твердым поглотителем, предназначенными для очистки от серы. После сероочистки газ смешивается с водяным паром (1:2,2). Парогазовая смесь с температурой 3650С направляется в печь 2, имеющую 44 радиантные трубы, которые заполнены катализатором. Конверсия протекает при 8500С.
Конвертированный газ поступает в пароперегреватель 4, в котором он нагревает пар до 4000С, затем в теплообменник 3 и с температурой 4200С проходит конвертор оксида углерода 5. Дымовые газы из печи, нагретые до 9000С, направляются в котел-утилизатор 6, в котором образуется насыщенный пар. Пар поступает в пароперегреватель 4. Выходящий из пароперегревателя пар с температурой 4000С используется для конверсии углеводородных газов. В конвертор для конверсии СО также добавляется пар с температурой 4000С.
После конвертора газы поступают в котел-утилизатор 6, охлаждаются до 1200С и проходят в конденсационную башню, орошаемую водой; оттуда газ при 300С подается на моноэтаноламиновую очистку от СО2. В результате получается водород 95-96%-ной чистоты.
При проведении конверсии метана под давлением достигается более полное использование тепла конвертированного газа в виде пара высокого давления, уменьшаются размеры оборудования и энергетические затраты на сжатие водорода.
Исходные данные:
Состав природного газа:
|
Вариант |
%(об.) СН4 (х1) |
%(об.) С2Н6 (х2) |
%(об.) С3Н8 (х3) |
%(об.) С4Н10(х4) |
%(об.) N2 (х5) |
|
1 |
98 |
0,4 |
0,03 |
0,15 |
1,42 |
|
2 |
97,8 |
0,5 |
0,2 |
0,1 |
1,4 |
|
3 |
98,5 |
0,25 |
0,05 |
0,06 |
1,14 |
- · Отношение объемов пар/газ в исходной смеси 2,5.
- · Степень конверсии газа по углероду 67% (Zс).
- · Гомологи метана разлагаются нацело.
- · Соотношение между СО и СО2 в конвертированном газе соответствует равновесию реакции при температуре газа у выхода из печи.
- · Температура паро-газовой смеси на входе в печь 3800С (t вх).
- · Температура паро-газовой смеси на выходе из печи 7000С(t вых).
- · Температура дымовых газов на выходе 8000С ((t дым. газ).
- · Теплопотери в окружающую среду принять равными 4% от прихода теплоты.
- · Давление в конверторе 1× 105Па (1атм) (Р).
- · Расчет вести на 100м3 природного газа (при нормальных условиях).
Порядок выполнения работы
I Материальный баланс трубчатой печи
Обозначим содержания, в м3 компонентов в конвертированном газе
СО2 – α;
СО – в;
Н2 – с;
водяного пара, вступившего в реакцию с углеводородами и СО – d.
- ØОпределяем количество углеводородов в пересчете на СН4 в конечном газе, м3:
(х1 + 2× х2 + 3× х3 + 4× х4)× (100 – Zс)
VСН4 = ───────────────────────
100
- ØСоставим балансовые уравнения по содержанию каждого элемента в исходном и конвертированном газах, в м3:
по углероду
х1 + 2× х2 + 3× х3 + 4× х4 = α + в + VСН4 (1)
из уравнения (1) находим α, выраженное через в.
по кислороду
(с учетом, что в исходной паро-газовой смеси содержится 100 × 2,5 = 250м3 Н2О):
250 × 0,5 = α + 0,5 × в + 0,5 × (250 – d)
откуда α + 0,5 × в - 0,5 × d = 0 (2)
по водороду
2 × х1 + 3× х2 + 4× х3 + 5× х4 + 250 = с + 2 × VСН4 + (250 – d) (3)
из уравнения (3) находим с, выраженное через d.
- Ø Определяем константу равновесия реакции Кр.
Соотношение СО и СО2 в конечном газе по условию определяется равновесием реакции конверсии оксида углерода водяным паром, так как при 7000С и 1× 105Па (1атм) равновесие этой реакции достигается весьма быстро (Кр = 1,54).
В соответствии с этим:
Рсо2 × РН2 α × с
Кр = ─────── = ───────── = 1,54 (4)
Рсо × РН2О в × (250 – d)
Подставляя значение α из уравнения (1) в (2), получаем в, выраженное через d.
Подставляя в уравнение (1) значение в, выраженное через d, находим α, выраженное через d.
Подставляем в уравнение (4) значения α, в, с, выраженные через d и находим d в м3.
Зная d, находим α, в, с, в м3.
- Ø Определяем количество водяного пара, вступившего в реакцию, м3
с углеводородами V = 100 – α
с окисью углерода V = α
Осталось в газе водяного пара V= 250 – 100 = 150м3
Состав газа после конверсии
Таблица 8.1 – Состав газа после конверсии
|
Компонент |
Влажный газ |
Сухой газ |
||
|
м3 |
% (об.) |
м3 |
% (об.) |
|
|
1 |
2 |
3 |
4 |
5 |
|
СН4 |
VСН4 |
|
VСН4 |
|
|
Н2 |
с |
|
с |
|
|
СО |
в |
|
в |
|
|
СО2 |
α |
|
α |
|
|
N2 |
х5 |
|
х5 |
|
|
Н2О |
V |
|
- |
- |
|
Итого |
|
100 |
|
100 |
Отношение пар/газ n = V/ ∑Vсухого газа,
где Vсухого газа – объем сухого газа в м3.
- Ø Определяем количество компонентов природного газа в кг:
х1
GСН4 = ─── × МСН4,
22,4
где МСН4 – молекулярная масса СН4
х2
GС2Н6 = ─── × МС2Н6,
22,4
где МС2Н6 – молекулярная масса С2Н6
х3
GС3Н8 = ─── × МС3Н8,
22,4
где МС3Н8 – молекулярная масса С3Н8
х4
GС4Н10 = ─── × МС4Н10,
22,4
где МС4Н10 – молекулярная масса С4Н10
х5
GN2 = ─── × МN2,
22,4
где МN2 – молекулярная масса молекулы азота
250
Gн2О = ─── × МН2О,
22,4
где МН2О – молекулярная масса молекулы воды
- Ø Определяем количество компонентов конвертированного газа из печи в кг:
VСН4
G = ─── × МСН4,
22,4
где МСН4 – молекулярная масса СН4
с
GН2 = ─── × МН2,
22,4
где МН2 – молекулярная масса молекулы водорода
в
GСО = ─── × МСО,
22,4
где МСО – молекулярная масса окиси углерода
α
GСО2 = ─── × МСО2,
22,4
где МСО2 – молекулярная масса СО2
V
G = ─── × МН2О,
22,4
- Ø Составляем материальный баланс трубчатой печи.
Таблица 8.2 – Материальный баланс трубчатой печи
|
Наименование |
кг |
м3 |
% (об.) |
|
1 |
2 |
3 |
4 |
|
Приход:
1. Природный газ СН4 С2Н6 С3Н8 С4Н10 N2
Всего сухого газа
2. Водяной пар
|
GСН4 GС2Н6 GС3Н8 GС4Н10 GN2
GН2О |
х1 х2 х3 х4 х5
100
250 |
х1 х2 х3 х4 х5
100 |
|
Итого |
|
|
- |
|
1 |
2 |
3 |
4 |
|
Расход:
1. Сухой газ из печи СН4 Н2 СО СО2 N2
Всего сухого газа
2. Водяной пар |
G G GСО G G
G |
VСН4 с в α х5
V |
Н2О (% об) из табл. 8.1 (графа 3) |
|
Итого |
|
|
100 |
II Тепловой баланс трубчатой печи
- ØПриход теплоты
1. Теплота, поступающая с паро-газовой смесью, кДж
Q1 = Vг× Сс.г× t вх + Vвод. пара × Свод. пара× t вх,
где Vг – количество природного газа (м3), по которому ведется расчет
(Vг =100м3);
Сс.г – средняя теплоемкость сухого газа при 3800С, кДж/(м3× 0С)
Сс.г = 1,965 кДж/(м3× 0С);
Vвод. пара – количество водяного пара в исходной газовой смеси, м3
(Vвод. пара = 250м3);
Свод. пара – средняя теплоемкость водяного пара при 3800С, кДж/(м3× 0С)
Свод. пара = 1,555 кДж/(м3× 0С);
t вх – температура паро-газовой смеси на входе в печь, 0С.
2. Теплота сгорания 1м3природного газа, определяется исходя из теплотворной способности компонентов и состава газа, кДж
q = q× + qС2Н6 × + qС3Н8 × + qС4Н10 ×,
где q- теплота сгорания СН4 при 180С и 1× 105Па (1атм), кДж/кмоль
(q= 889500 кДж/кмоль);
qС2Н6 – теплота сгорания С2Н6 при 180С и 1× 105Па (1атм), кДж/кмоль
(qС2Н6 = 1558000 кДж/кмоль);
qС3Н8 – теплота сгорания С3Н8 при 180С и 1× 105Па (1атм), кДж/кмоль
(qС3Н8 = 2297800 кДж/кмоль);
qС4Н10 – теплота сгорания С4Н10 при 180С и 1× 105Па (1атм), кДж/кмоль
(qС4Н10 = 2870000 кДж/кмоль).
3. Теплота сгорания х м3 природного газа, расходуемого на обогрев трубчатой печи, кДж
Q2 = q × х,
х – неизвестная величина
4. Теплота, вносимая сжигаемым газом при 180С, кДж
Q3 = х × С× t,
где С- средняя теплоемкость сухого газа при 180С (С= 2,08 кДж/м3×0С) ;
х – неизвестная величина
5. Общий приход теплоты (кроме теплоты, вносимой в печь воздухом, количество которого будет рассчитано ниже) составит, кДж:
Qприхода = Q1 + Q2 + Q3
- ØРасход теплоты
1. Теплота расходуется на проведение эндотермического процесса конверсии. Одновременно с конверсией СН4 и других углеводородов идет окисление СО водяным паром с выделением теплоты. Суммарный тепловой эффект протекающих при конверсии реакций определяем в соответствии с законом Гесса, по которому
Q = ∑∆Нк - ∑∆Нн,
где ∑∆Нк и ∑∆Нн – суммы энтальпий образования соединений в исходной и конечной смесях, кДж.
Q = ∆НCН4 × VСН4 + ∆НCО × в + ∆НCО2 × α + ∆НН2О × V – х1× ∆НCН4 – х2× ∆НC2Н6 –
– х3 × ∆НC3Н8 – х4× ∆НC4Н10 – Vвод. пара× ∆НН2О,
где ∆НCН4 =3300 кДж/м3;
∆НCО = 4930 кДж/м3;
∆НCО2 = 17600 кДж/м3;
∆НН2О = 10800 кДж/м3;
∆НC2Н6 = 3680 кДж/м3;
∆НC3Н8 = 4520 кДж/м3;
∆НC4Н10 = 5480 кДж/м3.
2. Теплота влажного конвертированного газа при 7000С, кДж
Qвл.к.г = ∑ (Vс.г из печи + V) × Ск.г × t вых,
где ∑ (Vс.г из печи + V) – таблица 8.2 (расход, графа3)
Ск.г – теплоемкость конвертированного газа, при 7000С
(Ск.г = 1,55 кДж/м3×0С);
t вых – температура паро-газовой смеси на выходе из печи, 0С.
3. Для определения расхода теплоты с дымовыми газами найдем количество их, образующееся при сжигании 1м3 природного газа до СО2 и Н2О, при коэффициенте избытка воздуха 1,25.
Необходимое количество кислорода для сжигания 1м3 газа в м3
VО2 = 1,25 × (+++)
Так как содержание кислорода в воздухе 21%(об.), воздуха необходимо, м3
Vвоздуха =
Содержание азота в воздухе, м3
V = Vвоздуха - V
Количество водяного пара, поступающее с воздухом при 180С и влажности воздуха 0,016м3/м3
Vвод.пара с воздухом = Vвоздуха× 0,016
Определяя состав дымовых газов в соответствии с реакциями
СН4 + 2О2 = СО2 + 2Н2О
С2Н6 + 3,5О2 = 2СО2 +3Н2О
С3Н8 + 5О2 = 3СО2 + 4Н2О
С4Н10 + 6,5О2 = 4СО2 + 5Н2О
находим, что при сгорании 1м3 газа образуется, м3
VСО2 = + + +
VН2О = + + +
Останется кислорода, м3
V= V -
Газ содержит водяных паров
Vвод. паров в газе = V + Vвод.пара с воздухом
Состав дымового газа, получаемого при сжигании 1м3природного газа
Таблица 8.3 – Состав дымового газа
|
Наименование |
м3 |
%(об.) |
|
СО2 О2 N2 Н2О |
VСО2 V VN2 Vвод. паров в газе |
|
|
Итого |
|
100 |
Расход теплоты с дымовыми газами составит, кДж
QI = (VСО2 + V+ VN2 + Vвод. паров в газе)× х × Сдым.газа× t дым. газ,
где х – количество природного газа, м3 (величина неизвестная);
Сдым.газа – средняя теплоемкость дымового газа такого состава при 8000С, отнесенная к 1м3, равна 1,48 кДж/(м3× 0С).
t дым. газ – температура дымовых газов на выходе 0С.
4. Приход теплоты с поступающим в печь воздухом (при 180С), кДж
Q4 = (Vвоздуха × Cвоздуха + Vвод.пара с воздухом× Свод. пара)× t × х,
где Cвоздуха - средняя теплоемкость воздуха при 180С, равная
0,983кДж/(м3× 0С);
Свод. пара – средняя теплоемкость водяного пара при 180С, равная
1,79кДж/(м3× 0С);
х – неизвестная величина
5. Уравнение теплового баланса трубчатой печи с учетом теплопотерь в окружающую среду (принимаем их равными 4% от прихода) имеет вид
0,96×( Qприхода + Q4) = Q + Qвл.к.г + QI
из уравнения теплового баланса трубчатой печи находим х, м3.
Затем находим, в кДж Q2, Q3, Q4, QI
Расход влажного воздуха, подаваемого в топку, составляет, м3
Vвл. воздуха = (Vвоздуха + Vвод.пара с воздухом) × х
Количество дымового газа
Vдым. газа =(VСО2 + V+ VN2 + Vвод. паров в газе)× х
Составляем тепловой баланс трубчатой печи.
Таблица 8.4 - Тепловой баланс трубчатой печи
|
Наименование |
кДж |
% |
|
Приход: 1. Теплота паро-газовой смеси 2. Теплота от сгорания природного газа 3. Теплота, вносимая сжигаемым газом 4.Теплота вносимая воздухом |
Q1 Q2 Q3 Q4 |
|
|
Итого |
|
100 |
|
Расход: 1. Теплота, затрачиваяемая на реакции конверсии 2. Теплота конвертированного газа 3. Теплота дымовых газов 4. Теплопотери |
Q Qвл.к.г QI Qприхода × 0,04
|
|
|
Итого |
|
100 |
Контрольные вопросы:
1. Назовите наиболее перспективный метод получения водорода.
2. Назовите стадии конверсии метана до водорода.
3. Расскажите технологическую схему получения водорода.
- Практическая работа №7 Тема: Расчет материального и теплового балансов производства синтез -газа паро-кислородной конверсией метана
- Практическая работа №6 Тема: Расчет материального и теплового балансов производства водорода и синтез-газа парокислородной газификацией нефтяных остатков
- Практическая работа 1 Тема: Расчет оптимальных выходов, степеней селективности и конверсии для независимых сложных химических реакций процессов нефтехимического синтеза.
- Принципиальная технологическая схема установки для производства водорода
- Практическая работа 5 Тема: Расчет материального баланса колонны синтеза аммиака.